Pictos « grossesse » sur les boîtes de médicaments : l’afa reste mobilisée
Les pictogrammes « grossesse » sur les boîtes de médicaments : l’afa partie prenante dans les axes d’amélioration.
Rappel des faits :
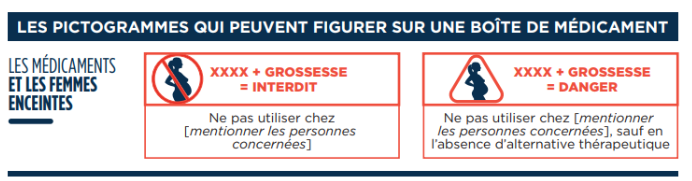
Le décret n°2017-550 du 14 avril 2017, les arrêtés du 5 mai 2017 et du 9 août 2017 imposent depuis le 17 octobre 2017 aux industriels commercialisant des médicaments ayant une AMM et dont le RCP comporte des informations indiquant qu’ils sont tératogènes ou foetotoxiques d’appliquer sur le conditionnement extérieur des boites de médicaments, selon les cas, un pictogramme de classe 1 (grossesse = danger, peut être utilisé en cas de grossesse s’il n’existe pas d’alternative thérapeutique) ou un pictogramme de classe 2 (grossesse = interdit, formellement contre indiqué en cas de grossesse).
L’apposition de ces pictogrammes déclenche potentiellement une situation de crise pour les prescripteurs et les patientes susceptibles de procréer, l’arrêt de traitement est susceptible de conduire à des situations dramatiques, voire à des décès.
Cependant, le CRAT a immédiatement alerté les autorités de santé sur les effets contre-productifs, voire délétères, du décret tel qu’il est rédigé, ce qui malheureusement se confirme depuis son application.
Une quinzaine de substances sont tératogènes chez l’humain (en dehors des antimitotiques), et une quarantaine sont foetotoxiques, ce qui représente environ 10% des spécialités sur le marché (liste des médicaments dangereux).
Seules ces spécialités devraient disposer d’un pictogramme pour attirer l’attention des professionnels de santé et des patientes en raison de leur effet nocif avéré chez l’humain. Or, environ 60 à 70 % des spécialités vont se voir apposer un pictogramme « Interdit » ou « Danger ». Quelles sont les raisons et les conséquences de cet écart ?
Dans ce décret, l’absence de précision sur un certain nombre de points cruciaux introduit une difficulté d’interprétation et une confusion qui incitent les firmes à élargir l’apposition des pictogrammes dans une optique de protection médico-légale.
- La nuance entre « Danger » et « Interdit » est un leurre en langage courant, et la distinction entre ces deux niveaux n’est absolument pas comprise par les professionnels de santé et encore moins par les patientes. Les deux pictogrammes sont donc indistinctement interprétés et inquiètent autant les professionnels (qui refusent de prescrire ou de délivrer quel que soit le pictogramme) que les patientes.
- Il n’est pas spécifié si la notion de tératogenèse ou de foetotoxicité doit être fondée sur des données humaines, ou si seuls les résultats des études de toxicité chez l’animal réalisées avant la mise sur le marché du médicament suffisent pour apposer des pictogrammes aussi alarmants. Or, la prédictivité qualitative (sévérité) et quantitative (fréquence) des résultats expérimentaux est très faible dans ce domaine et n’est en rien un garant d’effets similaires chez l’humain. L’expérience nous prouve d’ailleurs l’inverse, avec un nombre considérable d’effets reprotoxiques retrouvés chez l’animal dans les conditions expérimentales et une absence d’effet chez l’humain après la mise sur le marché. Actuellement, on assiste à l’apposition systématique d’un pictogramme sur la base des résultats chez l’animal, même en l’absence d’alerte chez l’humain.
- Ces textes incitent à fonder le choix des pictogrammes sur la présence ou pas d’alternatives thérapeutiques en cours de grossesse, or aucune définition, directive ou recommandation, n’accompagne cette disposition. En d’autres termes, le bénéfice thérapeutique, point crucial de la prise en charge des patientes enceintes, est laissé à l’appréciation des firmes, qui in fine décident du pictogramme à apposer, que des stratégies thérapeutiques aient déjà été produites ou pas par les professionnels de santé concernés (Recommandations pour la Pratique Clinique, conférences de consensus…). Ceci risque de conduire des patientes à refuser un traitement indispensable pour elles ou leur fœtus sur des bases non fondées.
L’Imurel est un des exemples aberrants de ce dispositif : L’ANSM (Agence nationale du médicament) ayant laissé la liberté aux industriels d’estimer quel était le pictogramme adapté à leurs produits. Il se trouve que HAC Pharma (princeps) et Mylan (générique) ont choisi le pictogramme 2 (grossesse = interdit), alors que EG Labo (générique) et Téva Santé (générique) ont choisi le pictogramme 1 (grossesse = danger). Si l’Imurel a été noté comme tératogène (malformations fœtales) chez l’animal, il se trouve qu’en 50 ans d’utilisation, plusieurs centaines de grossesses associées à une exposition au médicament à un terme quelconque de la grossesse, dont le premier trimestre, ont été rapportées. Le nombre de 1000 grossesses a été largement dépassé et ceci permet aux centres de référence sur les agents tératogènes (CRAT) d’écrire que l’Imurel n’est ni tératogène ni foeto-toxique, et de ne pas intégrer ce médicament dans la liste des médicaments tératogènes. L’interdiction de l’Imurel au cours de la grossesse est médicalement non justifiée. L’arrêt intempestif du traitement par des femmes surprises et terrorisées est susceptible d’induire des pertes de contrôle de la maladie, ce qui serait dangereux pour l’enfant comme pour la mère.
Ainsi, l’apposition du pictogramme grossesse-interdit sur les boîtes d’Imurel et d’azathioprine MYLAN déclenche une situation de crise pour les médecins et les patientes en âge de procréer, alors même qu’aucune information d’accompagnement spécifique n’a été délivrée aux malades et aux prescripteurs d’azathioprine, quelle que soit l’indication.
- La mise à jour des RCP est fréquemment en décalage par rapport à l’état des connaissances disponibles dans la littérature, faute d’actualisation régulière. Les pictogrammes se fondent donc pour une partie importante des RCP sur des données cliniques obsolètes.
Favorables à l’apposition d’un pictogramme qui permet d’informer les patientes des risques tératogènes d’un médicament, dès lors que ce risque est avéré. Cette apposition doit en revanche être absolument proscrite lorsque le caractère tératogène est écarté.
Demande que soit précisé par un nouvel arrêté que seule la tératogénicité et la foeto-toxicité dans l’espèce humaine impose mécaniquement l’application d’un pictogramme de type 1 ou 2 sur les boites de médicaments. A la lumière de ces éléments, le périmètre du décret devrait être revu afin d’en conserver l’intention initiale : seules les substances ayant fait la preuve de leur effet délétère pour tout ou partie de la grossesse humaine devraient être visées par une action de communication de cette nature, avec apposition d’un pictogramme spécifique. La liste des produits considérés comme dangereux à ce jour figure sur le site du CRAT.
Où en est le dossier ?
Depuis 2019 pas vraiment d’avancées, malgré des réunions à la direction générale de la santé. Mais les choses ont bougé récemment puisque la DGS a confié à l’ANSM la mission de créer une commission scientifique temporaire autour du sujet pour réouvrir les travaux. L’afa qui avait pris une part importante en 2019 dans le dossier a été conviée en tant que membre de la commission. L’objectif étant d’avoir deux types de réflexion, l’une portant sur le rationnel scientifique de l’apposition des pictos sur certains médicaments, l’autre plus pédagogique sur les améliorations en termes de communication au grand public dont les patientes atteintes de maladies chroniques.















